更新日:2026年1月6日
再生医療等について
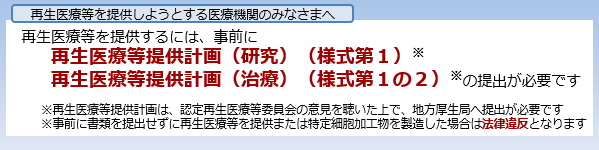
特定細胞加工物製造事業者や再生医療等提供機関は、1年ごとに定期報告が必要です。
お知らせ
- 令和7年3月25日より、臨床研究等提出・公開システム(jRCT)のURLが変更となりました。https://jrct.mhlw.go.jp/
- 国が行う特定細胞加工物等の製造の許可等における登録免許税及び手数料に係る事務処理について(令和7年12月23日医政研発1223第2号)NEW
- 特定細胞加工物等の製造の許可証及び認定証の書換え交付及び再交付の電子申請について (令和7年12月23日事務連絡)NEW
- 「特定細胞加工物の微生物学的安全性に関する指針」について(令和7年10月6日医政研発1006第1号)
- 再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改正する法律の施行等に伴う通知等の廃止について(令和7年5月30日医政研発0530第2号)
令和7年5月31日施行の法律改正に関するお知らせ(共通)
再生医療等提供計画(研究)の手続きに当たっては、令和7年5月31日から、法改正に伴う様式の改訂がjRCTに反映されるまでの間に、ご提出いただく様式の一部には特殊様式の添付が必須なものがあります。
- 再生医療等提供状況定期報告書等の記載要領について(令和7年10月17日事務連絡)
- 「再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改正する法律の施行等に伴う再生医療等の各種申請等のオンライン手続サイト及び臨床研究等提出・公開システムにおける取扱いについて」の一部改正について(令和7年8月21日事務連絡)
過去のお知らせ
令和7年5月31日施行の法律改正に関するお知らせ(特定核酸等を用いるもの)
改正法施行日から起算して1年を経過する日以降も特定核酸等を用いる医療の提供を継続しようとする場合は、移行措置期間の終了する前の最後の平日である令和8年5月29日(金)までに、厚生労働大臣へ再生医療等提供計画の提出を完了する必要がありますので、形式上の要件の確認・修正に要する期間等を考慮の上、令和8年4月30日(木)までに厚生労働省に提出ください。
過去のお知らせ
再生医療等安全性確保法に関する手続き
| 必要な書類の手続き | 医療機関、特定細胞加工物等製造施設、 委員会が必要とする手続きを説明しています。 【e-再生医療(再生医療等の各種申請等のオンライン手続サイト)】 |
| 申請等様式 | 申請等に用いる様式について掲載しています。 |
| 関係法令、 その他関係通知等 |
記載要領とQ&Aを掲載しており、 各書類の記載方法について説明しています。 |
| 研究として 再生医療等を 行う場合の手続き |
研究の提供計画に関する手続き。 【jRCT:臨床研究等提出・公開システム】 |
関係法令等
手続きに当たっては、厚生労働省内ホームページ等をご覧ください。
- 厚生労働省ホームページ
再生医療・遺伝子治療等について - 法律
平成25年11月27日に再生医療等安全性確保法が公布され、平成26年11月25日に施行されました。
本法の経過措置は平成27年11月24日に終了しています。
再生医療等の安全性の確保等に関する法律(e-Govへリンク)
法律の概要 - 施行令
再生医療等の安全性の確保等に関する法律施行令(e-Govへリンク) - 施行規則(省令)
再生医療等の安全性の確保等に関する法律施行規則(e-Govへリンク) - 局長通知
再生医療等の安全性の確保等に関する法律施行規則及び臨床研究法施行規則の一部を改正する省令の施行について(令和4年3月31日医政発0331第23号) - 課長通知
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施行令」、「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて(令和7年5月15日医政研発0515第18号) - 利益相反管理について
再生医療等研究の利益相反管理について(平成31年3月20日医政研発0320第1号)及び様式A-E - 作成例
様式第27「特定細胞加工物製造届書」作成例(PDF:1,607KB)
※平成27年4月13日、14日に、中国四国厚生局で開催された「平成27年度再生医療等安全性確保法制度説明会」の説明資料の抜粋版です。
再生医療等提供計画の手続きの方法
令和元年9月5日に開催した再生医療等の安全性の確保等に関する法律施行規則の改正に伴う説明会の資料 - 認定再生医療等委員会・再生医療等提供機関の一覧
問い合わせ
このページに関するお問い合わせ先
九州厚生局健康福祉部医事課
- 住所
- 〒812-0013 福岡市博多区博多駅東2-10-7 福岡第二合同庁舎2F
- 電話番号
- 092-472-2366
- メール
- k-ijika4@mhlw.go.jp


